...
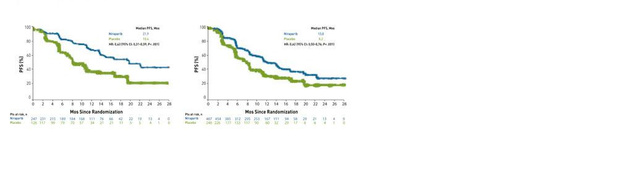
Le Pr Witteveen a débuté sa présentation avec un graphique quelque peu déprimant sur l'évolution de la survie à 5 ans du carcinome ovarien au cours des 30 dernières années, précisant de plus l'inexistence d'une réelle amélioration. Ainsi, pour les diagnostics posés dans les années 90, la survie à 5 ans était de 32% alors qu'elle est de 38% pour les diagnostics posés entre 2008 et 2012.Le traitement primaire est d'ailleurs également le même depuis déjà un certain nombre d'années, à savoir une cytoréduction maximale associée à une chimiothérapie à base de platine. Néanmoins, il n'existe encore aucun consensus international clair concernant l'intérêt d'une chirurgie de réduction tumorale initiale ou d'intervalle, ni concernant la thérapie intrapéritonéale. Récemment, à l'ESMO, un certain nombre d'études réalisées avec des inhibiteurs de la PARP ont été considérées comme étant très encourageantes.Les résultats positifs de l'étude OVIPHEC sont également très encourageants. Cette étude néerlandaise évalue l'efficacité de la CHIP (chimiothérapie hyperthermique intrapéritonéale) sur les tumeurs n'entrant pas en ligne de compte pour un traitement ne reposant que sur une chirurgie de réduction tumorale initiale, en raison du caractère étendu de la maladie. La CHIP est une technique consistant à rincer l'abdomen en fin d'intervention au moyen d'une solution chauffée de chimiothérapie. Au cours de cette étude, des patientes ont d'abord été traitées par trois cures de chimiothérapie standard (carbo + paclitaxel) puis randomisées pour bénéficier d'une chirurgie standard (chirurgie de réduction tumorale d'intervalle) avec ou sans CHIP, pour ensuite recevoir 3 cures de chimiothérapie supplémentaires.Cette étude a mis en évidence un gain en termes de survie de 11,8 mois (HR : 0,67) dans le groupe CHIP. Pour les patientes pouvant subir une chirurgie de réduction tumorale initiale suivie de 6 cures de chimiothérapie, l'effet de la CHIP en association avec cette chirurgie initiale est encore inconnu. C'est pour cette raison qu'une étude OVIPHEC-2 a débuté afin d'examiner si l'ajout d'une CHIP à une chirurgie de réduction tumorale initiale permet d'augmenter la survie globale des patientes.La seconde partie de l'exposé traitait des inhibiteurs de la PARP. La PARP est une protéine naturellement présente dans le corps, favorisant la réparation du matériel génétique des cellules endommagé. Mais elle favorise aussi la réparation des cellules cancéreuses : les inhibiteurs de la PARP bloquent l'activité de cette protéine, freinant la réparation des cellules cancéreuses et leur croissance. Les tumeurs n'ayant pas de bonnes capacités de réparation de leur matériel génétique endommagé sont donc sensibles aux inhibiteurs de la PARP. C'est le cas chez les femmes atteintes d'un cancer ovarien associé à une mutation du gène BRCA.Dans notre pays, l'olaparib est le seul inhibiteur de la PARP actuellement remboursé, mais uniquement dans le carcinome ovarien séreux de haut grade avec mutation BRCA. De plus, la patiente doit avoir reçu au moins deux cures préalables de chimiothérapie à base de platine et y avoir présenté une réponse partielle ou complète. Les études présentées à l'ESMO et résumées ici par le Pr Witteveen sont dès lors très intéressantes car elles vont évaluer l'utilisation d'inhibiteurs de la PARP au sein d'une population beaucoup plus large.Tant l'étude PRIMA que l'étude VELIA ont été réalisées en 1re ligne. Dans l'étude PRIMA, les patientes atteintes d'un carcinome ovarien de stade III-IV ayant présenté une bonne réponse à une chimiothérapie à base de platine ont été randomisées selon un rapport 1 sur 2 pour recevoir du niraparib ou un placebo. Le niraparib a d'abord été administré à raison de 300 mg une fois par jour puis, compte tenu des informations issues de publications précédentes, à raison de 200 mg chez les patientes ayant un poids corporel inférieur à 77 kg et/ou un nombre de plaquettes inférieur à 150.000/µl.Le niraparib a été administré pendant trois ans, en cas d'absence de toxicité significative. II est important de noter que les patientes ayant subi une chirurgie initiale de réduction tumorale complète ont été exclues de l'étude, soit un groupe de patientes présentant un bon pronostic... Le critère d'évaluation primaire était la survie sans progression (PFS). Dans la population totale, une PFS significativement meilleure a été atteinte par les patientes ayant reçu le niraparib (HR : 0,62). Dans le groupe présentant un déficit de recombinaison homologue (DRH), la différence entre le placebo et le niraparib est encore plus marquée, avec une PFS médiane de 21,9 mois pour le niraparib et de 10,4 pour le placebo (HR = 0,43 (IC à 95 % : [0,31 ; 0,59] ; p < 0,001)) (figure 1).La sous-analyse du statut de recombinaison homologue est également intéressante. Tant les patientes porteuses d'une mutation BRCA que celles présentant un autre DRH ou n'ayant aucun problème de mécanisme de réparation présentent une meilleure PFS sous niraparib que sous placebo. Les effets indésirables sont connus : fatigue, nausées et légère toxicité médullaire nécessitant parfois une adaptation de la dose, ce qui fut le cas au cours de cette étude.L'étude VELIA s'intéressait aussi aux femmes atteintes d'un carcinome ovarien de stade III-IV. Cette étude comportait trois bras : le bras chimiothérapie + vélaparib suivie d'un traitement d'entretien par vélaparib ; un bras chimiothérapie + vélaparib mais suivie d'un traitement d'entretien par placebo ; le bras témoin où les patientes n'ont reçu qu'une chimiothérapie. Le critère d'évaluation primaire était la PFS.À la différence de l'étude PRIMA, la thérapie n'a été administrée que pendant 2 ans, dont 6 mois en association avec une chimiothérapie. La dose de vélaparib administrée en association avec la chimiothérapie était plus faible que la dose du traitement d'entretien (150 mg contre 400 mg). L'analyse présentée à l'ESMO n'inclut que la comparaison entre le bras témoin et le bras vélaparib administré en association et en traitement d'entretien.La PFS est significativement meilleure avec le vélaparib qu'avec le placebo, tant dans la population totale (HR : 0,68 (IC 95 % : 0,56-0,83 ; p < 0,001)) que dans la population DRH (HR : 0,57 (IC 95% : 0,43-0,76 ; p < 0,001)) et dans le groupe avec mutation BRCA (HR : 0,44 (IC 95% : 0,28-0,68 ; p < 0,001)) (figure 2). Le fait que la chimiothérapie et le vélaparib soient d'abord administrés ensemble pendant 6 mois complique évidemment l'évaluation de la toxicité. La toxicité médullaire est l'effet indésirable de grade III le plus fréquent.Le Pr Witteveen a conclu qu'un traitement d'entretien primaire du carcinome ovarien de stade avancé par un inhibiteur de la PARP permet d'augmenter la PFS, en particulier dans le sousgroupe des patientes présentant un déficit de recombinaison homologue. Au cours des deux études, aucun nouveau problème de sécurité n'a été constaté. Les inhibiteurs de la PARP administrés en traitement d'entretien semblent ainsi s'imposer comme un nouveau standard pour la prise en charge du carcinome ovarien de stade avancé chez les patientes ayant obtenu une réponse préalable à la chimiothérapie classique.