Voici un aperçu des divers points clés sur le cancer urothélial abordés par le Pr Christof Vulsteke, oncologue médical (UZAntwerpen et l'hôpital Maria Middelares à Gand).
Nouvelles données relatives aux inhibiteurs de PARP
Après un passage en revue du schéma de traitement actuel du cancer urothélial, le Pr Vulsteke a souligné qu'avant le congrès de l'ASCO GU, aucun résultat d'étude positif n'était encore disponible en ce qui concerne les inhibiteurs de PARP chez les patients atteints d'un cancer urothélial prétraité. La figure 1 donne un aperçu des nouvelles études évaluant des inhibiteurs de PARP dont les résultats ont été présentés durant le congrès de l'ASCO GU.
BAYOU, une étude de phase II, randomisée, multicentrique, a évalué la combinaison de durvalumab (DUR) et d'olaparib (OLA), un inhibiteur de PARP, en traitement de 1re ligne chez des patients n'entrant pas en ligne de compte pour une chimiothérapie au platine (1). Le Pr Vulsteke a indiqué que tous les patients " cisplatin inéligible" pouvaient participer à cette étude, mais que lors de l'analyse des données, une stratification a été opérée en fonction des mutations du gène de réparation de l'ADN présentes. 1 patient sur 5 présentait une mutation, dont 41,9% du gène ATM et 22,6% du gène BRCA2.
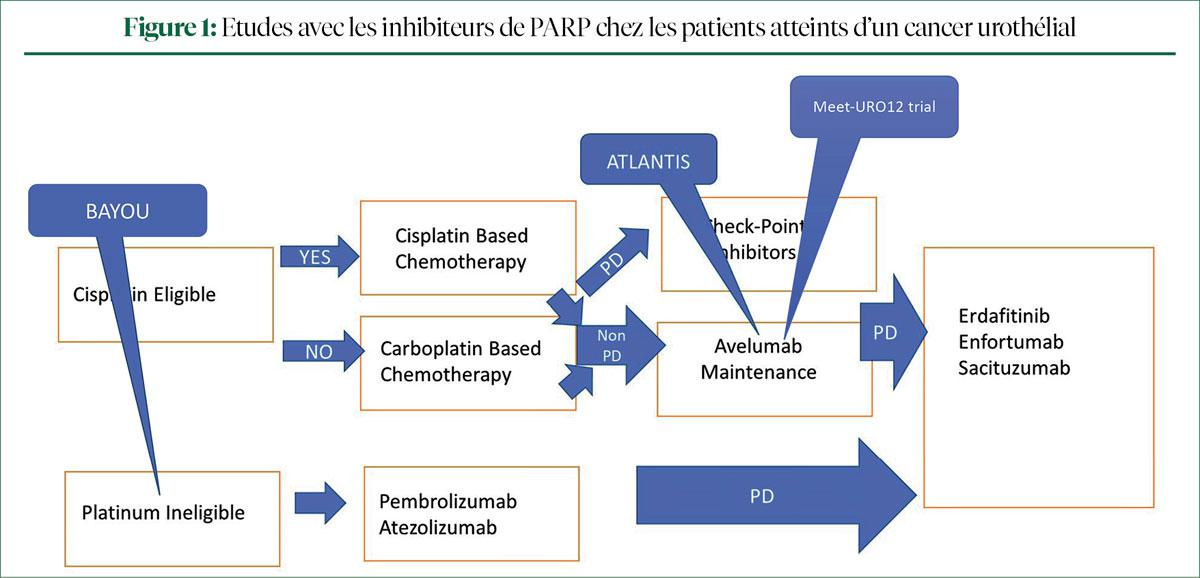
Aucune différence n'a été observée en ce qui concerne la survie sans progression (PFS) et la survie globale (OS) entre le groupe DUR/OLA (N=78) et le groupe DUR (N=76). Les patients porteurs d'une mutation génétique présentaient une meilleure PFS (resp. 5,6 mois vs 1,8 mois), mais la différence n'était pas significative. Ces résultats indiquent un rôle possible des inhibiteurs de PARP chez les patients atteints d'un cancer urothélial porteurs de mutations du gène de réparation de l'ADN, selon le Pr Vulsteke. Il a conclu en déclarant que, comme le pronostic des patients porteurs d'une mutation du gène BRCA2 est plus sombre, il est préférable de stratifier les patients en fonction du type de mutation génétique dès le début d'une étude.
L'analyse définitive du groupe rucaparib dans l'étude ATLANTIS a également été présentée durant le congrès de l'ASCO (2). Les patients atteints d'un carcinome urothélial métastatique présentant une bonne réponse après 4 à 8 cycles de chimiothérapie au platine et porteurs d'une mutation génétique ont reçu un traitement d'entretien par rucaparib, un inhibiteur de PARP. Le recrutement a été arrêté après 40 patients en raison de la pandémie de coronavirus et de l'approbation entre-temps de l'avélumab dans ce contexte. Les résultats montrent une tendance vers la significativité, avec une PFS médiane de 35,3 semaines dans le groupe rucaparib et de 15,1 semaines dans le groupe placebo. Le Pr Vulsteke a souligné qu'il s'agit d'une petite étude, mais que les résultats sont prometteurs et que de plus amples études évaluant le rucaparib sont nécessaires.
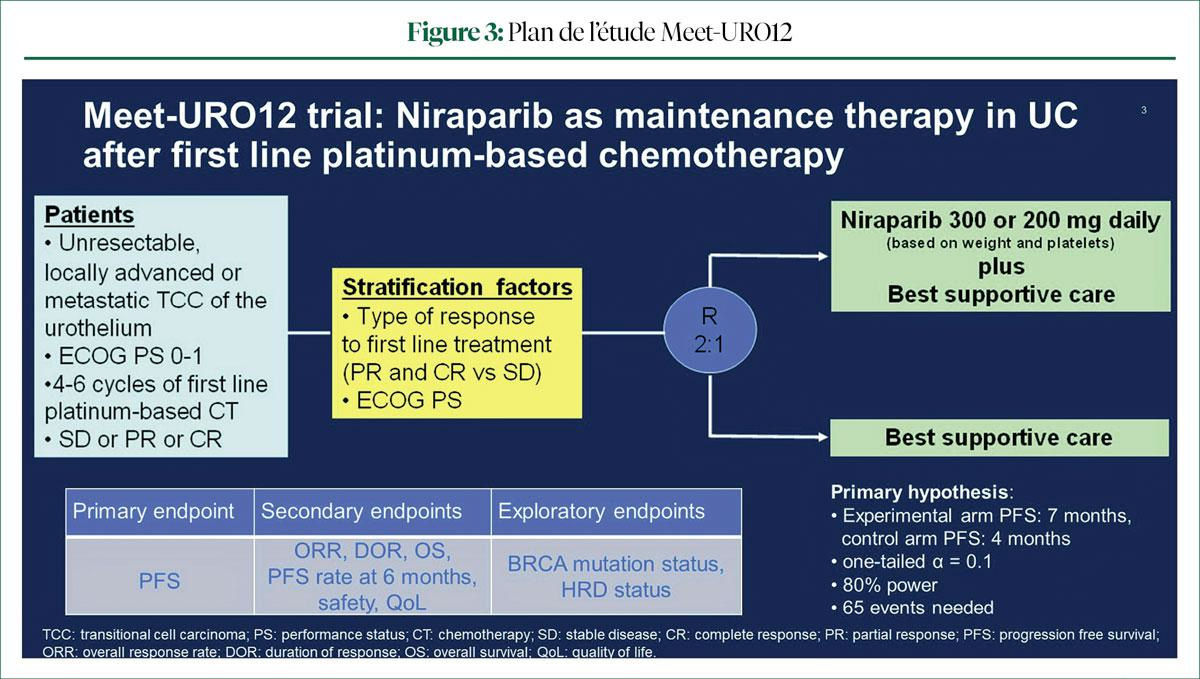
Il a terminé en survolant les résultats de l'étude Meet-URO12 de phaseII, lors de laquelle un traitement d'entretien par niraparib chez des patients atteints d'un carcinome urothélial avancé et présentant des mutations du gène de réparation de l'ADN après un traitement de 1re ligne par chimiothérapie au platine n'a pas donné lieu à un avantage en termes de survie (Figure 2) (3).
Sur base de ces études, le Pr Vulsteke a conclu que les inhibiteurs de PARP peuvent être efficaces chez les patients atteints d'un cancer urothélial présentant des mutations du gène de réparation de l'ADN, ainsi que cela a déjà été montré pour d'autres types de tumeur. Des études de phase III de grande envergure sont nécessaires afin d'apporter des clarifications.
Nouvelles données sur les conjugués anticorps-médicament
L'enfortumab védotin (EV) est un conjugué anticorps-médicament (ADC): cet anticorps cible la protéine nectine-4 sur les cellules cancéreuses, et est associé à une forme de chimiothérapie. Celle-ci est ainsi délivrée spécifiquement aux cellules cancéreuses, réduisant les effets indésirables. L'étude EV302 a défini la norme pour l'EV en combinaison avec l'immunothérapie dans le cancer de la vessie métastatique. Le Pr Vulsteke s'attend à un remboursement de ce traitement.
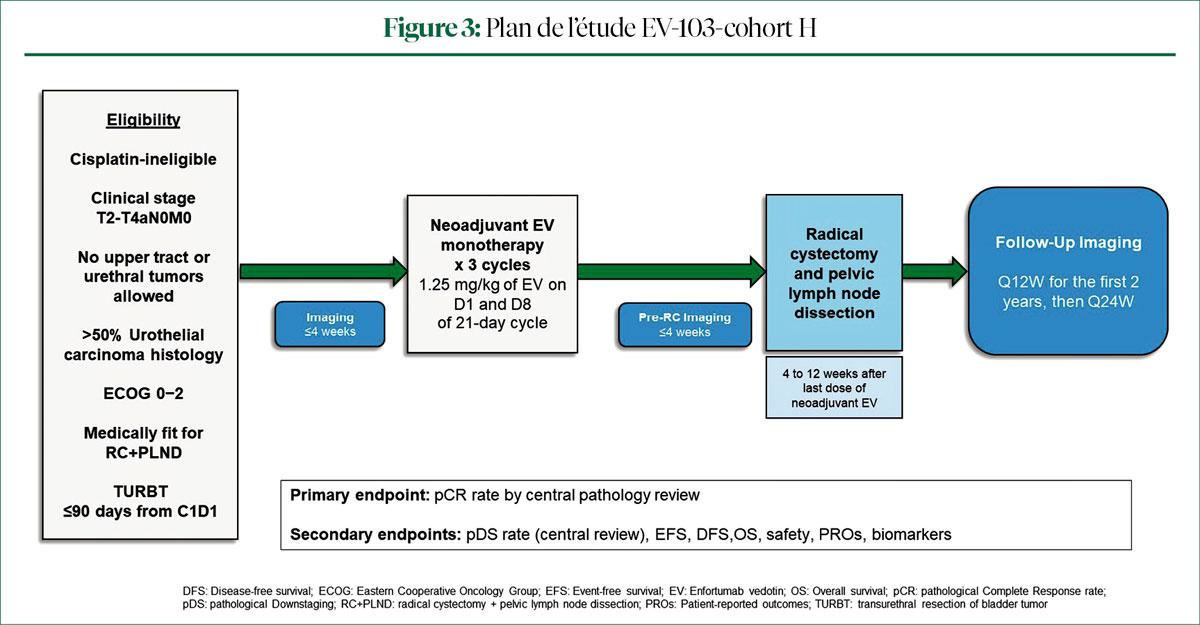
La chimiothérapie néoadjuvante (NACT) avant une chirurgie améliore les chances de survie des patients atteints d'un cancer de la vessie infiltrant le muscle, qui entrent en ligne de compte pour une chimiothérapie au cisplatine. Aucun traitement néoadjuvant n'est actuellement disponible pour les patients non éligibles à une chimiothérapie au platine. Par conséquent, les résultats de la cohorteH de l'étude EV103, qui a évalué l'EV dans un contexte préopératoire, sont attendus avec impatience (Figure 3).
Dans cette étude, la NACT par 3 cycles d'EV en monothérapie a été évaluée chez des patients de stade cT2-T4aN0M0, qui n'entraient pas en ligne de compte pour une chimiothérapie au cisplatine (4). Les raisons les plus fréquentes à cette non-éligibilité étaient une clairance de la créatinine <60ml>down-staging pathologique a été observé chez 50,0% des patients. Le Pr Vulsteke a souligné que 68,2% des patients de cette étude étaient cT2, ce qui peut expliquer le pourcentage plus élevé de réponse pathologique complète, un critère de substitution pour l'OS.
L'étude de phase II TROPHY-U-01 Cohort 3 a évalué un autre EV, le sacituzumab govitécan (SG), en combinaison avec le pembrolizumab chez des patients atteints d'un cancer urothélial métastatique présentant une progression de la maladie après une chimiothérapie au platine (5). La PFS médiane était de 5,5 mois. La combinaison est efficace, mais la réponse objective est inférieure aux prévisions (34%), selon le Pr Vulsteke qui signale que le SG possède une action davantage myélosuppressive et qu'il est dès lors peut-être préférable de ne pas le combiner avec le pembrolizumab.
Le Pr Vulsteke a conclu en déclarant que la combinaison d'ADC avec l'immunothérapie est prometteuse, mais que des études de plus grande ampleur sont nécessaires pour déterminer la combinaison optimale.
https://medcc.be/events/rewatch-events/rewatch-be-gus-post-asco-gu-virtual-symposium-2022/
Références:
1. Rosenberg JE, abstract 437.
2. Crabb SJ, abstract 436.
3. Vignani F, abstract 442.
4. Petrylak DP, abstract 435.
5. Grivas P, abstract 434.